10×Tris-Tricine-SDS-PAGE阴极缓冲液
产品名称: 10×Tris-Tricine-SDS-PAGE阴极缓冲液
英文名称: 10×Tris-Tricine-SDS-PAGE阴极缓冲液
产品编号: HZ1205
产品价格: 0
产品产地: 中国/上海
品牌商标: 沪震生物
更新时间: 2023-08-17T10:24:20
使用范围: null
- 联系人 : 鲍丽雯
- 地址 : 上海市闵行区闵北路88弄1-30号第22幢AQ136室
- 邮编 : 200612
- 所在区域 : 上海
- 电话 : 139****0749
- 传真 : 021-60345367
- 邮箱 : www.shzbio.net
10×Tris-Tricine-SDS-PAGE阴极缓冲液
中文名:10×Tris-Tricine-SDS-PAGE阴极缓冲液
英文名:10×Tris-Tricine-SDS-PAGE阴极缓冲液
CAS:N/A
级别:N/A
分子量:N/A
分子式:N/A
纯度:N/A
储存条件:RT
| 产品编号 | 规格 | 目录价(¥) | 优惠价(¥) | 数量 | 操作 |
|---|---|---|---|---|---|
| HZ1205-500ml | 500ml | 640 | 640 | ||
| HZ1205-100ml | 100ml | 240 | 240 |
产品说明:
Tricine-SDS-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE)是目前电泳法变性分离多肽的主要方法。此试剂可以制备20/50块 0.75 mm× 14 cm×14 cm 胶。
使用方法:
推荐在分离多肽时使用由 4%浓缩胶、10%隔离胶和 16%分离胶从上到下组成的三层 Tricine-SDS-PAGE 胶,下面为配制该胶的流程。
1. 配制 30 mL 16%分离胶和 9 mL 10%隔离胶(足够灌两块 0.75 mm× 14 cm×14 cm 胶)。
A) 标记 2 个 50 mL 的三角瓶,按下表的用量加入各成分:
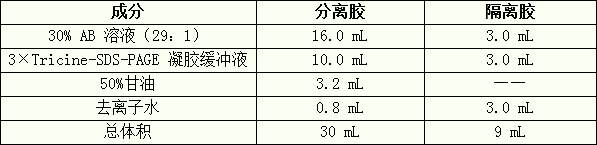
B) 混匀后真空脱气 10-15 分钟。
C) 在分离胶瓶中加入 150 uL 10%的 APS 溶液和 30 uL TEMED 溶液, 轻轻旋转混匀。
D) 灌胶。用一根巴斯德吸管,将分离胶溶液沿着一个隔条的边缘加到玻璃板夹层中,直到溶液的高度距离玻璃上沿还有 5 cm。由于分离胶比重比隔离胶大,故可在其凝固前直接灌隔离胶。
E) 在隔离胶瓶中加入 75 uL 10%的 APS 溶液和 15 uL TEMED 溶液, 轻轻旋转混匀。
F) 灌胶。用巴斯德吸管,将积层胶溶液缓缓地沿着一侧隔条边缘加入到 玻璃平板夹层中,直到溶液离玻璃板顶部约 3 cm 高为止。
G) 盖 1cm 高的水饱和的异丁醇使胶面跟氧气隔绝(氧气会抑制胶的凝固;此处水饱和的异丁醇可用水代替,但效果会差一些)。
H) 让分离胶和隔离胶在室温聚合 30-45 分钟。
2. 配制 9 mL 4%浓缩胶(足够灌两块 0.75 mm×14 cm×14 cm 胶)。
A) 在一个 50 mL 的三角瓶中,先按下表的用量加入各成分:
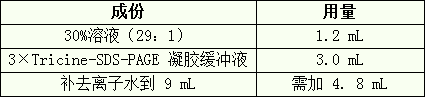
B) 混匀后真空脱气 10-15 min。
C) 将 75 uL 新鲜配制的 10%的过硫酸铵溶液和 15 uL TEMED 溶液加 入到溶液中,轻轻旋转混匀。
D) 灌胶。用巴斯德吸管,将积层胶溶液缓缓地沿着一侧隔条边缘加入到 玻璃平板夹层中,直到夹层中的溶液离玻璃板顶部约 1 cm 高为止。
E) 插入 0.75 mm 厚的塑料梳子,再补加浓缩胶溶液填满梳子间的空隙。 注意避免产生气泡。
F) 让浓缩胶在室温聚合 30-45 分钟。
3. 小心拔出塑料梳子,在上层缓冲槽中加入 1×阴极缓冲液,并用 1×阴极缓冲液冲洗加样孔。
注:10×Tricine-SDS-PAGE阴极缓冲液用去离子水1:9稀释成 1×阴极缓冲液。
4. 在电泳装置的下层缓冲液槽中加入 1×阳极缓冲液。
注:10×Tricine-SDS-PAGE阳极缓冲液用去离子水1:9稀释成 1×阴极缓冲液。
5. 在密封的螺盖微量离心管中,用2×Tricine多肽上样缓冲液按1: 1 的比例稀释蛋白样品,于 100℃煮沸 3-5 分钟。
注意:如果样品是蛋白沉淀物,则加入 50-100 uL 新配的 1×Tricine-SDS-PAGE 上样缓冲 液溶解;如果样品是蛋白稀溶液,可先浓缩蛋白质。与Tricine-SDS-PAGE 上样缓冲液混合后的样品如未经 100℃加热灭活蛋白酶,切勿放于室温。
6. 上样。如果用考马斯亮蓝染色,对于成分复杂的蛋白质样品,上样量最好为 20 uL(含 25-50 ug 总蛋白质);对于只有一种或几种蛋白质的样品, 上样量最好为 1-10 uL。如果用银染,上样量可减少 10-100 倍。
7. 电泳。先 30 V 恒压电泳 1 h(对 0.75mm×14cm×14cm 的胶而言), 然后 150 V 恒压电泳 4-5 h。注:本产品的 Tricine-SDS-PAGE 上样液 使用了考马斯亮蓝 G-250 作为指示剂,其泳动速度比最小的肽还快。
8. 终止电泳,取出凝胶进行后续的实验处理(最好用银染染色,节约样品)。
注意:考染或银染时,基本步骤同蛋白电泳,但任何一步(尤其是固定步 骤)的处理时间都不要超过 20 分钟,否则多肽非常容易扩散出 PAGE 胶 而降低检测的灵敏度。
特别提示:本公司的所有产品仅可用于科研实验,严禁用于临床医疗及其他非科研用途!
