无损伤钙离子探针“GCaMP-X”
产品名称: 无损伤钙离子探针“GCaMP-X”
英文名称: “GCaMP-X”
产品编号:
产品价格: 6000
产品产地: null
品牌商标: null
更新时间: null
使用范围: null
- 联系人 :
- 地址 : 武汉市东湖高新技术开发区光谷七路128号 中科开物产业园枢密脑科学技术有限公司
- 邮编 : 430074
- 所在区域 : 湖北
- 电话 : 181****1572
- 传真 : 027-65023363
- 邮箱 : marketing@brainvta.com
一、无损伤钙离子探针“GCaMP-X”
北京航天航空大学刘晓冬课题组独家授权!欢迎咨询!
GCaMP-X优势:
1. 精准、特异且安全无损;
2. 特别适合超长时程(≥4周)钙信号的监测。
测试结果:
测试病毒:AAV-hSyn-GCaMP6m-XC,滴度:1.0x10^12,血清型:2/9;
对照病毒:AAV-hSyn-GCaMP6m,滴度:1.2x10^12,血清型:2/9;
注射区域:在同一只小鼠左脑皮层区域注射GCaMP6m,右脑皮层区域注射GCaMP6m-XC;
注射量:各100 nl。
图一:同一只小鼠左右脑皮层分别注射GCaMP6m和GCaMP6m-XC病毒,表达3周时长,左脑皮层神经元出现GCaMP6m显著进核现象,而右脑皮层神经元GCaMP6m-XC无进核现象。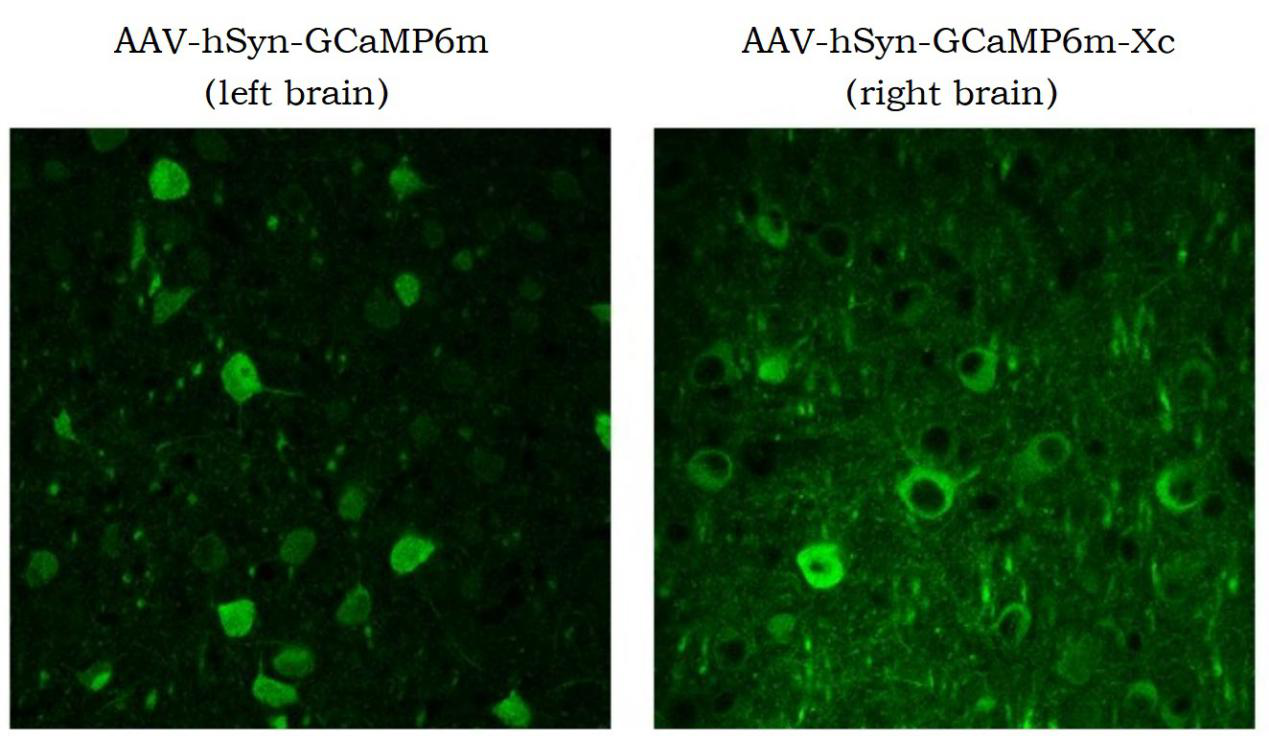
图一、 病毒注射3周后表达状态对比(刘晓冬课题组提供)
图二:步骤同上,表达13周时长,左脑皮层神经元GCaMP6m显著进核,而右脑皮层神经元GCaMP6m-XC依然无进核现象。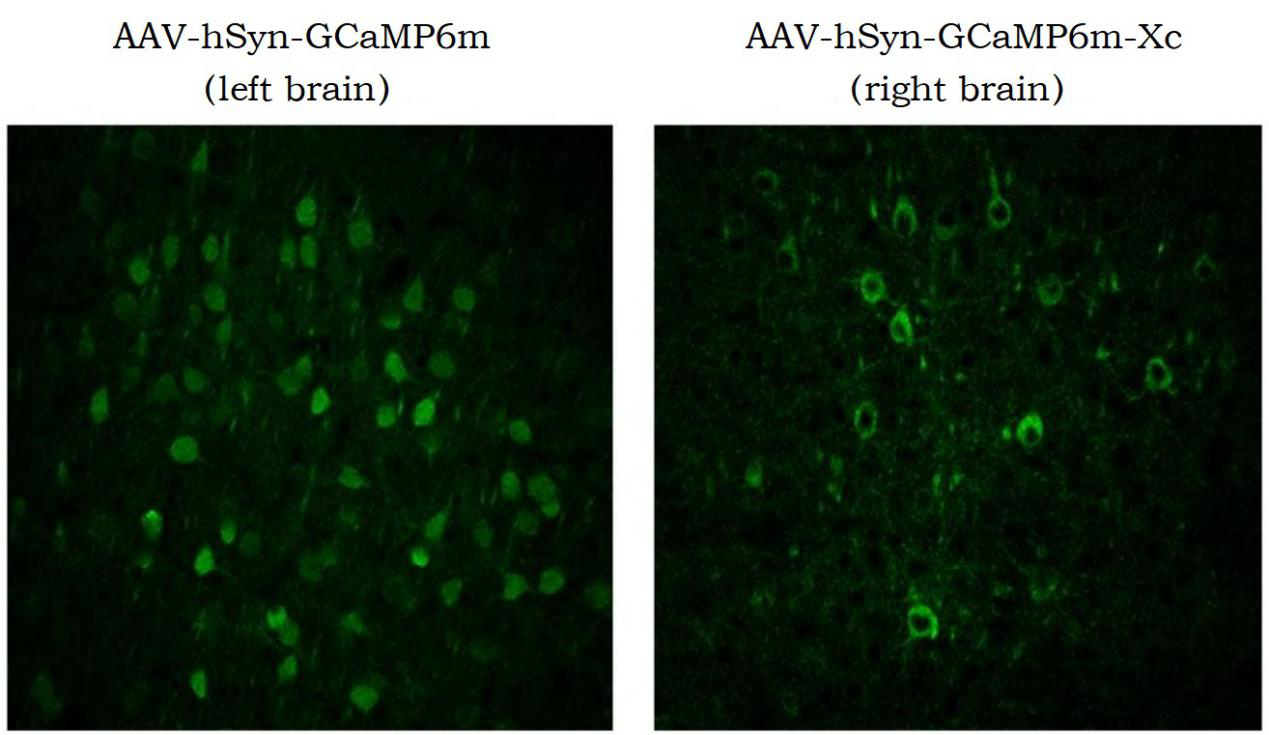 图二、 病毒注射13周后表达状态对比(刘晓冬课题组提供)
图二、 病毒注射13周后表达状态对比(刘晓冬课题组提供)
注意:低滴度GCaMP6m-XC表达量相对较低,可能会不利于在体双光子实验,推荐使用者使用10^13高滴度病毒,可有效提高表达量,有利于在体双光子实验。
二、相关原理:
许多重要的生物学过程如增殖、转录、代谢、胞吐、收缩和凋亡等都有Ca2+的参与,因此,人们付出了巨大的努力来开发和改进分子工具来监测和量化细胞Ca2+的时空动态。利用基因编码钙离子指示剂(GECIs)进行荧光成像,在细胞群、单个细胞或亚细胞水平上检测Ca2+取得了快速进展。钙离子成像技术是利用可以感应Ca2+浓度的钙离子指示剂,检测的是细胞或组织中Ca2+的浓度变化,将钙浓度变化转化为荧光信号,从而使细胞电活动转化为可记录的光信号。钙离子指示剂分为两种,一种为化学指示剂,另一种为现在普遍使用的遗传编码指示剂,例如GCaMP。GCaMP由绿色荧光蛋白(green fluorescent protein , GFP)、钙调蛋白(calmodulin, CaM)和肌球蛋白轻链激酶的一段肽段序列M13构成。当有Ca2+结合CaM时,CaM发生构象变化,其轻链区可以结合M13,致使GFP在特定波长的光照下其发色团的质子化作用增强,吸光度增加从而使GFP发出强烈的荧光。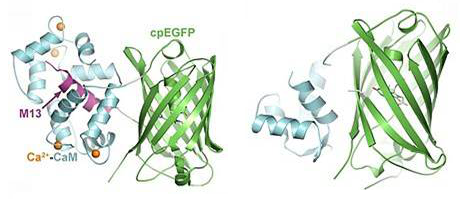
GCaMP的结构及作用示意图(来源于维基百科)
然而,据报道GCaMP在多个方面造成了意想不到的“副作用”,主要是GCaMP引起的细胞损伤。GCaMP可能损害细胞和组织的整体健康,例如GCaMP2转基因小鼠心脏的心肌肥大【1-2】,以及神经元的细胞毒性或死亡【3-4】;在GCaMP5转基因小鼠的海马神经元中观察到放电频率的增加【5】。这些副作用似乎与GCaMP在细胞核内的异常堆积密切相关,通常伴随着神经元内Ca2+动力学的衰减【3-4, 6】。
2018年4月17日,北京航空航天大学生物医学工程高精尖创新中心刘晓冬研究组在《Nature Communications》在线发表了题为“Improved Calcium Sensor GCaMP-X Overcomes the Calcium Channel Perturbations Induced by the Calmodulin in GCaMP”的论文。该研究首次揭示了含有CaM的GCaMP干扰了L型钙通道(CaV1)的门控和信号传导,破坏Ca2+动力学和基因表达,并通过GCaMP氮端引入能够特异结合apoCaM的保护元件,设计出了新一代无损伤钙离子探针——GCaMP-X,有效地保护了依赖于CaV1的兴奋-转录耦合免受干扰,同时仍表现出部分GCaMP的优良Ca2+感应特性。
GCaMP干扰神经元L型电压门控钙通道(CaV1.3)
CaV1.3是神经元表达的CaV1通道的一个主要亚型,与细胞核内的转录信号紧密耦合。作者发现,GCaMP能与CaV1.3结合,导致CaV1.3的门控显著增强,钙离子内流增加(图1)。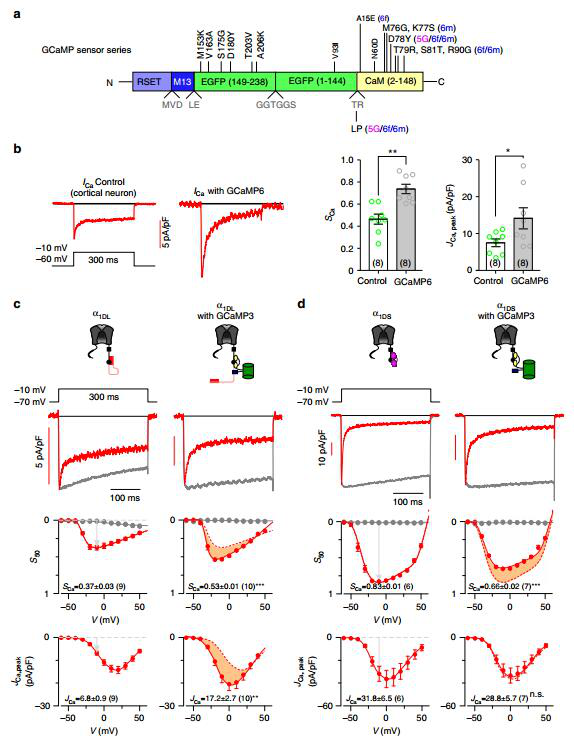
图1. GCaMP干扰神经元L型电压门控钙通道(CaV1.3)
GCaMP导致神经元退化和凋亡
作者还发现,GCaMP也会干扰CaM正常情况下响应CaV1.3钙信号的核迁移过程,长时程表达时引发GCaMP异常核聚集。入核GCaMP扰乱了转录因子CREB信号通路的正常运转,导致神经元退化和凋亡(图2)。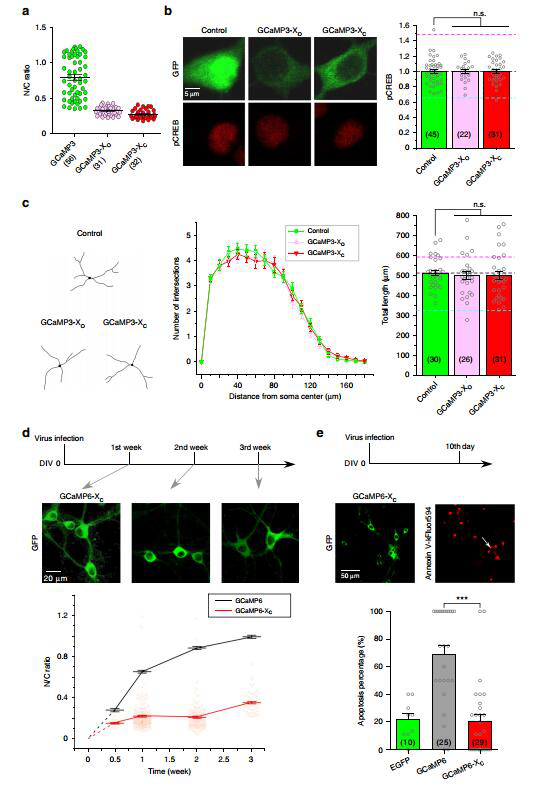
图2. GCaMP导致神经元退化和凋
GCaMP-X避免了对钙通道门控的干扰
作者在GCaMP氮端引入了特异性apoCaM保护元件,合成了新一代钙离子探针——GCaMP-X。GCaMP-X有效地解决了有害核积累、急性和慢性Ca2+失调、转录信号异常和细胞形态异常等问题,同时仍表现出GCaMP的优良Ca2+感应特性(图3)。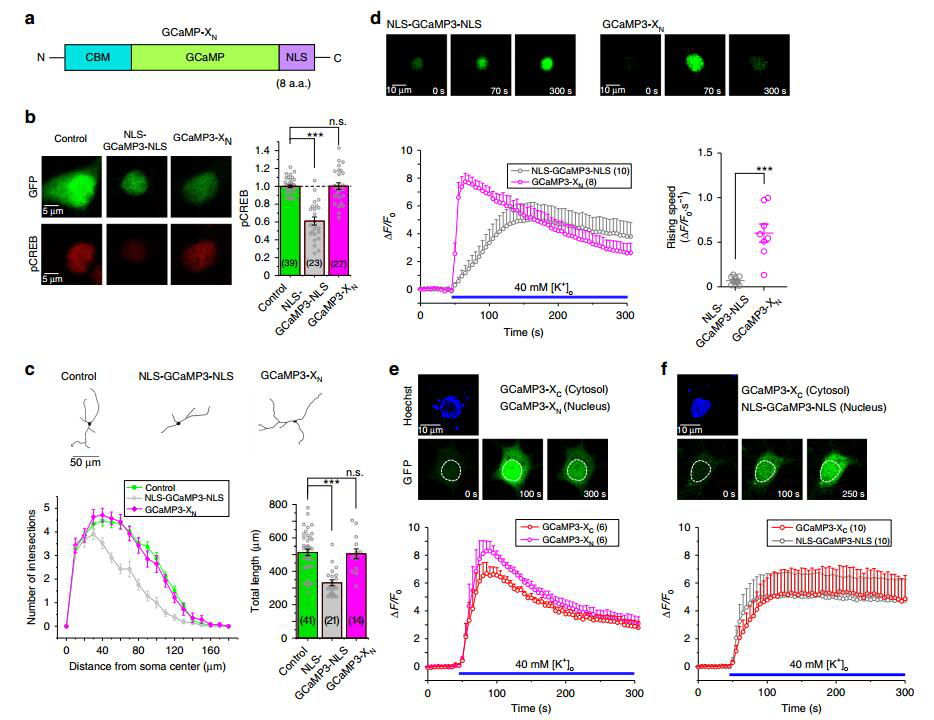
图3. GCaMP-X避免了对钙通道门控的干扰
GCaMP-X在长时程的钙离子监测中更有优势
作者用电穿孔法在机械敏感的外毛发细胞中转染GCaMP6m或GCaMP6m-XC,在短时间的细胞培养中(1天,DIV1),GCaMP6m-XC与GCaMP6m在监测Ca2+信号时无明显差异。而在较长时间的细胞培养( 3天,DIV3)中,GCaMP6m的副作用(例如干扰外毛发细胞中的CaV1.3)将出现。将100、300或500 ms的射流脉冲施加到细胞上,与表达GCaMP6m-XC的细胞相比,GCaMP6m表现为较弱的Ca2+信号反应,引起了Ca2+信号的衰减,而GCaMP6m-XC避免了这个问题(图4)。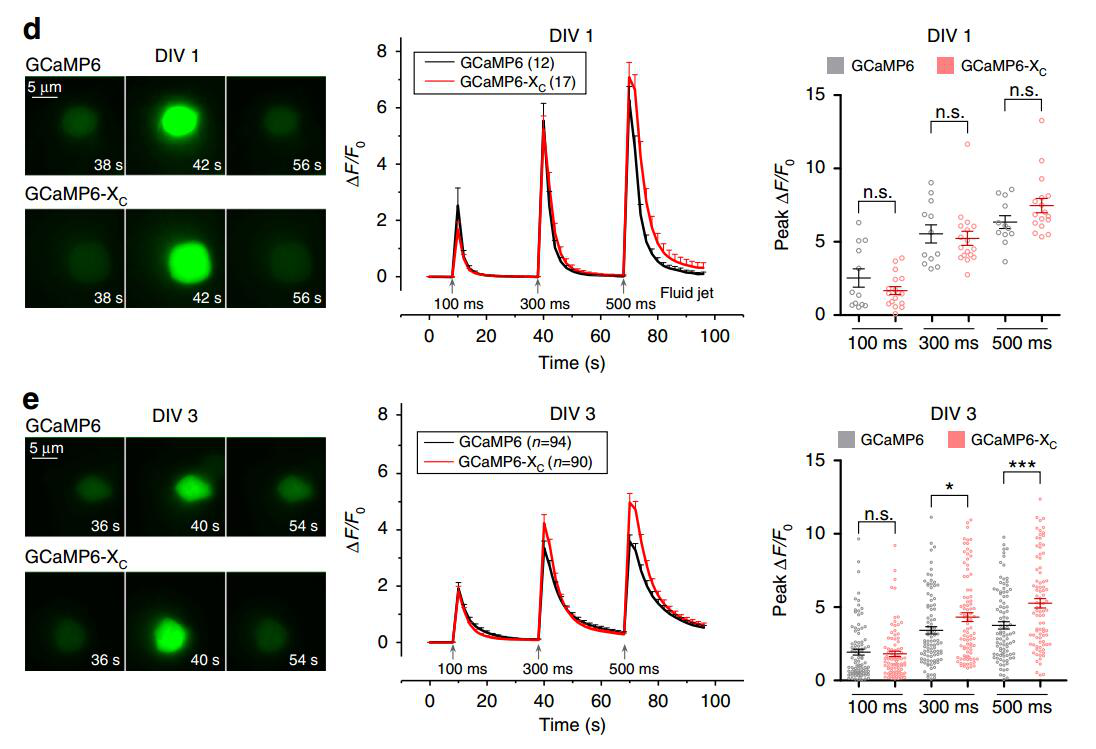
图4. GCaMP6m-Xc与GCaMP6m的钙离子监测比较
作者进一步在GCaMP碳端加入定位序列,如:检测近膜钙信号的GCaMP-XM探针,以及特异性定位于细胞核的GCaMP-XN探针,以实现监测胞质、膜下和核钙信号,满足不同实验研究的需要。新一代无损伤探针GCaMP-X有效地解决了传统GCaMP探针的弊端,能够安全无损、长时程、精准、特异、多细胞器的定量钙信号监测。这项研究也对未来基于CaM的分子工具的设计有指导意义。
刘晓冬课题组致力于如下几个方面的研究:1)电压门控钙通道CaV门控-信号耦联(如兴奋-转录耦联)机制及调控;2)基于新型钙探针GCaMP-X的长时程、亚细胞钙信号定量监控;3)感觉刺激响应型钙通道TRP的结构-功能研究;4)重要钙通道的病生理关联。此论文是该实验室继前期工作(《自然》Nature 2010;《细胞•报告》 Cell Reports 2015;《e生命》eLife 2017;及《自然•通讯》 Nature Communications 2018等)的最新研究进展。该项研究得到了国家自然科学基金委、北京市自然科学基金委、清华大学麦戈文脑科学研究所等方面的支持。
三、枢密科技GCaMP-X产品列表:
| 产品编号 | 产品名称 | 启动子 | Cre/Flp依赖 |
| PT-1464 | rAAV-hSyn-GCaMP6m-XC-WPRE-hGH polyA | hSyn | — |
四、该产品被引用文献:
Yang, Yaxiong. et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications 9, Article number: 1504 (2018)
https://www.nature.com/articles/s41467-018-03719-6
