
TUNEL 绿色荧光检测试剂盒
产品名称: TUNEL 绿色荧光检测试剂盒
英文名称: Fluorescence and Colorimetric TUNEL Apoptosis Assay Kit
产品编号: M3026
产品价格: 0
产品产地: Mbchem
品牌商标: Mbchem
更新时间: null
使用范围: null
- 联系人 :
- 地址 : 上海市浦东新区国际医学园区康新公路3399弄3号楼
- 邮编 : 201203
- 所在区域 : 上海
- 电话 : 159****9102 点击查看
- 传真 : 点击查看
- 邮箱 : marketing@majorbio.com
TUNEL 绿色荧光检测试剂盒
Fluorescence and Colorimetric TUNEL Apoptosis Assay Kit
一、 说明
1.1 背景介绍
细胞凋亡是细胞的一种基本生物学现象,在生物体进化、内环境的稳定以及系统发育中发挥着重要的作用。细胞凋亡发生在正常的细胞周期循环中,并发生形态学和生理生化的特征性改变,比如细胞皱缩,细胞间连接消失,线粒体膜电位消失,通透性改变,核质浓缩,核膜核仁破碎,DNA降解成为约180bp-200bp 的片段;胞膜有小泡状突起,膜内侧磷脂酰丝氨酸外翻到膜表面,胞膜结构仍保持完整,最终凋亡细胞遗骸被分割包裹为几个凋亡小体,并迅速被周围专职或非专职吞噬细胞吞噬。以上改变发生在不同的细胞凋亡阶段。
细胞凋亡的一个显著特点是细胞染色体的DNA降解,这是一个较普遍的现象。这种降解非常特异并有规律,所产生的不同长度的DN**段约为180-200bp的整倍数,而这正好是缠绕组蛋白寡聚体的长度,提示染色体DNA恰好是在核小体与核小体的连接部位被切断,产生不同长度的寡聚核小体片段,实验证明,这种DNA的有控降解是一种内源性核酸内切酶作用的结果,该酶在核小体连接部位切断染色体DNA,这种降解表现在琼脂糖凝胶电泳中就呈现特异的梯状Ladder图谱,而坏死呈弥漫的连续图谱。
1.2 检测原理

本试剂盒采用TUNEL( TdT mediated dUTP Nick End Labeling)法,应用末端脱氧核糖核苷酸转移酶(Terminal Deoxynucleotidyl Transferase,TdT)在凋亡细胞断裂的DNA的3´-羟基(3´-OH)末端催化掺入荧光素-12-脱氧三磷酸尿苷(FITC-12-dUTP)。FITC-12-dUTP标记的DNA可以用荧光显微镜直接观察或者用流式细胞仪定量。 试剂盒对标记反应进行了优化,采用最佳比例的荧光素标记和未标记dNTP 进行3’-OH 末端的核苷酸掺入,使得同一个断裂的DNA 片段末端可以形成更长的“标记尾巴,该“标记尾巴”减少了相邻掺入dNTP上标记基团的空间位阻,增加每个断裂片段后的荧光基团数目, 降低荧光基团相邻后可能造成的聚集和淬灭,从而提高检测灵敏度,减少非特异性反应。
二、 产品组成和储存条件
检测次数:50 次
检测方法:荧光显微镜或流式细胞仪
样本类型:石蜡包埋组织切片、组织冰冻切片、细胞涂片以及细胞悬液
试剂盒组分: 5×平衡缓冲液(5×Equilibration Buffer) 1.5ml
FITC-12-dUTP标记混合物(FITC-12-dUTP Labeling Mix) 250μl
重组TdT酶(Recombinant TdT Enzyme) 50μl
蛋白酶K(Proteinase K) 2mg/ml储液 100μl
*请使用者自备: 仪器耗材:小型染色缸、湿盒(塑料/玻璃容器与吸水纸)、盖玻片、封口膜
实验试剂: 二甲苯,梯度稀释乙醇溶液(100%、90%、80%、70%),Triton® X-100, DNA酶I, PI ( Sigma目录号# P4170),DAPI (Sigma目录号#D9542),不含甲醇的甲醛(普通甲醛为了稳定都加有甲醇,不可使用; 多聚甲醛可直接替代不含甲醇的甲醛;),20mM EDTA (pH 8.0),PBS,DNA酶I缓冲液。
储存条件:5×平衡缓冲液、重组TdT酶和蛋白酶K储存于–20℃。 FITC-12-dUTP标记混合物避光储存于–20℃。这些组分要避免反复冻融。
三、 注意事项
本试剂盒提供的FITC-12-dUTP标记混合物是对光敏感的。标记混合物以及孵育缓冲液和包含标记混合物的载玻片要避免光照。
平衡缓冲液包含二甲胂酸钾(potassium cacodylate)。避免接触皮肤和眼睛。使用该试剂时戴好手套。
四、 实验方案
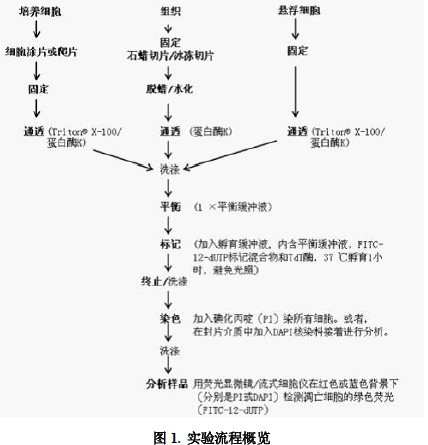
4.1 样本预处理方案
A. 石蜡包埋组织切片
1、室温下将石蜡组织切片放入二甲苯中浸泡5 分钟。更换新的二甲苯再浸泡5 分钟以彻底脱掉石蜡。
2、室温下用100%乙醇浸泡切片5 分钟,更换新的100%乙醇再浸泡5 分钟。
3、室温下用梯度乙醇(90、80、70%)各浸洗1 次,每次3 分钟,逐渐增加水分。
4、用PBS轻轻润洗切片,并用滤纸小心吸干玻片上样本周围多余的液体。这时可用石蜡笔或疏水笔在样品周围描绘样品分布的轮廓,便于下游透性处理和平衡标记操作。在实验过程中,切勿让样品干燥。处理好的样本放在湿盒中保持样本的湿润。
5、按1:100 的比例,用 PBS作为稀释液来稀释2mg/ml的蛋白酶K溶液,使其终浓度为20μg/ml。每个样本需要100μL蛋白酶K溶液。
6、每个样本上滴加100μL浓度为20μg/ml的蛋白酶K 溶液,使其被全部覆盖,室温孵育20 分钟。 注意:蛋白酶K帮助组织和细胞对后续步骤的染色试剂通透。孵育时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,过短则可能造成透性处理不充分,影响标记效率。为得到最好的结果,可能需要优化蛋白酶K孵育的时间。
7、用PBS溶液润洗样本。 轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。处理好的样本放在湿盒中保持样本的湿润。
B. 组织冰冻切片
该操作流程与石蜡包埋组织切片相似,除了将脱蜡步骤替换为短暂的水化步骤,并将蛋白酶K 的处理时间缩短到10 分钟。在进行该实验检测前需固定冰冻组织。为了避免在清洗步骤中的样本在玻片上损失,建议不用洗瓶清洗,而是将玻片浸在PBS溶液中2-3 次进行清洗。注意:在操作中避免样本干燥!
1、将玻片浸没在4%多聚甲醛溶液(溶于PBS)中,室温孵育15 分钟。
2、轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。
3、将玻片浸没在PBS溶液中,室温孵育15 分钟。
4、轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。这时可用石蜡笔或指甲油在样品周围描绘样品分布的轮廓,便于下游透性处理和平衡标记操作。
5、按1:100 的比例,用 PBS作为稀释液来稀释2mg/ml的蛋白酶K溶液,使其终浓度为20μg/ml。每个样本需要100μL蛋白酶K溶液。
6、每个样本上滴加100μL浓度为20μg/ml的蛋白酶K 溶液,使其被全部覆盖,室温孵育10分钟。(注意:蛋白酶K帮助组织和细胞对后续步骤的染色试剂通透。孵育时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,过短则可能造成透性处理不充分,影响标记效率。为得到最好的结果,可能需要优化蛋白酶K孵育的时间。)
7、在盛有PBS溶液的敞口烧杯中浸没清洗样本2-3 次。
8、轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。处理好的样本放在湿盒中保持样本的湿润。
C. 细胞爬片/涂片
细胞爬片的准备:在Lab-Tek®载玻片小室(Chamber Slides)上培养贴壁细胞。在凋亡诱导处理之后,用PBS洗两遍载玻片。进入后续实验。
细胞涂片的准备:
a. 多聚赖氨酸包被的载玻片的准备:吸取50–100μl 0.01%(重量体积比)多聚赖氨酸水溶液(Sigma Cat.# P9155或Sigma Cat.# P8920,1:10用水稀释)滴至每一片预清洗过的玻璃载玻片的表面。在将要用于固定细胞的区域将多聚赖氨酸溶液涂散为一薄层。在载玻片干了之后,迅速用去离子水漂洗,然后让包被的载玻片在空气中晾干30-60分钟。多聚赖氨酸包被的载玻片在使用前能在室温储存数月。
b. 以大概2 × 107个细胞/ml的浓度将细胞重悬在PBS中。吸50–100μl细胞悬液滴于多聚赖氨酸包被的载玻片上。用一片干净的载玻片轻柔的涂开细胞悬液。进入后续实验。
1、 固定细胞,将载玻片浸入装有4%新鲜配制于PBS中的多聚甲醛的染色缸中,在4℃放置25分钟。
2、洗涤载玻片,将其浸入PBS中,室温放置5分钟。重复用PBS洗一次。
轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。这时可用石蜡笔或指甲油在样品周围描绘样品分布的轮廓,便于下游透性处理和平衡标记操作。
3、按1:100 的比例,用 PBS作为稀释液来稀释2mg/ml的蛋白酶K溶液,使其终浓度为20μg/ml。每个样本需要100μL蛋白酶K溶液。
4、每个样本上滴加100μL浓度为20μg/ml的蛋白酶K 溶液,使其被全部覆盖,室温孵育5分钟(也可浸于0.2% 配制于PBS中的Triton® X-100溶液中,室温孵育5分钟进行通透处理)。 注意:蛋白酶K帮助组织和细胞对后续步骤的染色试剂通透。孵育时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,过短则可能造成透性处理不充分,影响标记效率。为得到最好的结果,可能需要优化蛋白酶K孵育的时间。
5、在盛有PBS溶液的敞口烧杯中浸没清洗样本2-3 次。
6、轻轻去掉多余液体,并用滤纸小心吸干载玻片上样本周围的液体。处理好的样本放在湿盒中保持样本的湿润。
4.2. DNA酶处理阳性对照的步骤(可选的)
检测DNA断裂的阳性对照可下所述进行。在样本通透处理之后,用DNA酶I处理细胞来准备阳性对照载玻片。
注意:DNA酶I处理固定的细胞会引起染色体DNA的断裂,产生许多可标记的DNA 3’-末端。下面叙述的流程通常会引起被处理的大多数细胞显现绿色荧光。
1、加100μl DNA酶I缓冲液到固定的细胞上,室温孵育5分钟。
2、轻叩掉液体,加入100μl 含5.5–10 units/ml DNA酶I的缓冲液,室温孵育10分钟。
3、轻叩载玻片去掉多余的液体,并将载玻片在装有去离子水的染色缸中彻底洗3–4次,该染色缸是专门用于阳性对照的。
注意:阳性对照载玻片必须使用单独的染色缸。否则,来自阳性对照载玻片上残余的DNA酶I活性可能会在实验载玻片上引入高的背景。
4.3. 标记及检测
1、按1:5 的比例用去离子水稀释5×TdT平衡缓冲液(每个样本需用20μl 5×缓冲液和80μl去离子水混合稀释成100μl缓冲液)。
2、滴加100μl 1×TdT 平衡缓冲液使其全部覆盖待检样本区域,室温孵育10-30分钟。或者将载玻片放入一个含有1×TdT平衡缓冲液的缸中,保证缓冲液没过样本。在平衡细胞的同时在冰上解冻FITC-12-dUTP标记混合物,并且依照表1,准备足够量的用于所有实验的和可选阳性对照反应的TdT孵育缓冲液。 对于面积小于5cm2的一个标准反应, 其体积是50μl, 用50μl乘以实验和阳性对照反应的数目来确定所需TdT孵育缓冲液的总体积。对于表面积更大的样本,可成比例的增大试剂体积。
3、在平衡后的区域周围用吸水纸吸掉100μl平衡缓冲液中的大部分,然后在5cm2面积的细胞上加上50μl TdT孵育缓冲液。不要让细胞干掉。
4、把塑料盖玻片盖在细胞上以保证试剂的平均分布。在湿盒的底部放上用水浸湿的纸巾。将载玻片置于湿盒内,在37℃孵育60分钟。将湿盒用铝箔纸包裹以避免光照。
注意:塑料盖玻片在使用前可以切成两半。折起盖玻片的边缘以便于移除和操作。
在第3步完成之后,载玻片要避光。
5、移除塑料盖玻片,并将切片置于PBS溶液中室温孵育5分钟。
6、 轻轻去掉多余液体,换用新鲜的PBS溶液室温孵育5分钟。重复该步骤1 次。
7、用滤纸轻轻擦掉样本周围及背面的PBS溶液。
注意:为了降低背景,载玻片在用PBS洗一遍之后,可再用含0.1% Triton® X-100和5mg/ml BSA的PBS洗三次,每次5分钟,这样游离的未反应的标记物可以清除较干净。
8、样本在染色缸中染色,在黑暗中将载玻片浸入装有PI溶液的染色缸,室温放置5分钟,此处PI溶液是用PBS新配稀释到1μg/ml的。
可选操作:样本在染色缸中染色,在黑暗中将载玻片浸入装有DAPI溶液的染色缸,室温放置5分钟,此处DAPI溶液是用PBS新配稀释到2μg/ml的。
9、洗涤样本,将载玻片浸入去离子水中,室温放置5分钟。重复两次,总共洗三次。
10、滴干载玻片上多余的水并且用吸水纸擦拭细胞周边的区域。
11、立即在荧光显微镜下分析样本,用标准的荧光过滤装置在520 ± 20nm的荧光下观察绿色荧光;在>620nm下观察PI的红色荧光,或在460nm观察蓝色的DAPI。如有必要,载玻片能在4℃黑暗条件下存放过夜。
注意:PI/DAPI能将凋亡和未凋亡的细胞都染成红色/蓝色。只在凋亡的细胞核中才有FITC-12-dUTP掺入而定位的绿色荧光。
4. 4. 流式细胞术检测悬浮细胞的步骤
1、将3–5 × 106个细胞用PBS在4℃离心(300 × g)洗两次,然后重悬在0.5ml PBS中。
2、固定细胞,加入5ml 1% 配制于PBS中的多聚甲醛溶液,冰上放置20分钟。
3、细胞在4℃ 300 × g离心10分钟,去上清并且重悬于5ml PBS。重复洗一次并把细胞重悬在0.5ml PBS中。
4、通透细胞,加入5ml冰上预冷的70% 乙醇,在–20℃ 孵育4小时。细胞能在70%乙醇中–20℃ 的条件下保存一周。 或者,细胞可用0.2% 配制于PBS中的Triton® X-100溶液通透,室温放置5分钟。
5、细胞在300 × g离心10分钟并且重悬于5ml PBS。 重复离心并把细胞重悬在1ml PBS中。
6、转移2 × 106个细胞至一个1.5ml的微量离心管。
7、300 × g离心10分钟,去上清并把沉淀重悬在80μl 1×平衡缓冲液(按1:5 的比例用去离子水稀释5×TdT平衡缓冲液)中。室温孵育5分钟。
8、在平衡细胞的同时,在冰上融解FITC-12-dUTP标记混合物,并且依照表1,准备足够量的用于所有反应的TdT孵育缓冲液。对于2 × 106个细胞的一个标准反应,其体积是50μl,用50μl乘上反应数目来确定所需TdT孵育缓冲液的总体积。
9、细胞在300 × g离心10分钟,去上清并把沉淀重悬在50μl TdT孵育缓冲液中。37℃孵育60分钟,避免光照。每隔15分钟用微量移液器轻轻重悬细胞。
10、加入1ml 20mM EDTA终止反应. 用微量移液器轻柔混匀。
11、300 × g离心10分钟,去上清并把沉淀重悬在1ml 0.1% 配制于PBS中的Triton® X-100溶液,其中含5mg/ml牛血清白蛋白(BSA)。重复一次,总共洗两次。
12、300 × g离心10分钟,去上清并把细胞沉淀重悬在0.5ml PI溶液中(用PBS新配稀释到5μg/ml),其中包含250μg 无DNA酶的RNA酶A。
13、在黑暗中室温孵育细胞30分钟。
14、用流式细胞仪分析细胞。测量520±20nm的FITC-12-dUTP的绿色荧光和>620nm的PI的红色荧光。
注意:PI将凋亡和未凋亡的细胞都染成红色。只在凋亡的细胞核中有FITC-12-dUTP掺入而定位的绿色荧光。
五、 操作实例:喜树碱(Camptothecin)诱导的HL-60细胞凋亡的检测
在含10%胎牛血清、2mM谷氨酰胺、1%的青霉素和链霉素的RPMI 1640培养液中培养HL-60细胞, 置于37℃,5% CO2培养箱中。将细胞密度调至6 ×105个细胞/ml。 喜树碱处理的终浓度为0.2μg/ml (储液溶解在DMSO中), 在37℃,5% CO2培养箱中孵育5小时。阴性对照的细胞用等体积的DMSO处理,并且在相同的条件下孵育。收细胞,按4.1.C节方案制备细胞涂片,用荧光显微镜分析或按4.4节方案用流式细胞仪来分析。

六、 问题诊断
Q. 高背景(如,未凋亡细胞的强绿色荧光背景)
A. 非特异性掺入FITC-12-dUTP。不要让细胞干掉;
标记反应完成,载玻片在用PBS洗一遍之后,可再用含0.1% Triton® X-100和和5mg/ml BSA的PBS洗三次,每次5分钟。
Q. 荧光信号弱
A. 蛋白酶K或Triton® X-100的通透不充分。 通过调整通透剂的孵育时间优化通透步骤。
Q. 组织切片从载玻片上脱落
A. 组织切片粘附之前的包被不充分。在展片之前,用3 -氨丙基三乙氧基硅烷(3-aminopropyl triethoxysilane,TESPA; Sigma Cat.# A3648)包被显微镜载玻片比多聚赖氨酸(poly-L-lysine)效果更好。
Q. 最后显微镜或流式细胞仪分析只剩下很少的细胞
A. 在操作过程中丢失大量细胞:
提高起始的细胞量。
在制备贴到显微镜载玻片的细胞悬液时,离心过程中用含1% BSA的PBS洗细胞。
在制备细胞悬液时,离心过程中用含1% BSA的PBS洗细胞。
七、 缓冲液及溶液组分
1X PBS (pH 7.4)
137mM NaCl
2.68mM KCl
1.47mM KH2PO4
8.1mM Na2HPO4
PI 溶液 (1mg/ml)
称取10mg PI溶于10ml PBS中。在0–4℃避光储存溶液。使用时适量稀释。
DAPI 溶液 (1mg/ml)
称取10mg DAPI溶于10ml PBS中。在0–4℃避光储存溶液。使用时适量稀释。
DNA酶I(DNase I)缓冲液
40mM Tris-HCl (pH 7.9)
10mM NaCl
6mM MgCl2
10mM CaCl2
1% 甲醛溶液
将6.25ml 16%不含甲醇的甲醛混入90ml PBS。加几滴1N氢氧化钠,混匀并调节pH值至7.4。用PBS定容至100ml。每次使用前新鲜配制。
4%甲醛溶液
将25ml 16%不含甲醇的甲醛混入70ml PBS。加几滴1N氢氧化钠,混匀并调节pH值至7.4。用PBS定容至100ml。每次使用前新鲜配制。
4% 多聚甲醛溶液
在通风橱中称取4g多聚甲醛,加PBS至100ml。装于密闭容器中在65℃水浴加热溶解2小时。4℃储存溶液,在4℃至少两周是稳定的。
10% Triton® X-100溶液
在烧杯中混合85ml高压灭菌去离子水和10ml Triton® X-100溶液,放置于搅拌处用磁力搅拌棒混匀。用水定溶至100ml。
